Обзор эффективности и безопасности нестероидных противовоспалительных препаратов для лечения острого приступа подагрического артрита
ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, Санкт-Петербург, Россия ООО «НИЦ Эко-безопасность», Санкт-Петербург, Россия
ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, Санкт-Петербург, Россия
ВВЕДЕНИЕ
Эпидемиологические исследования последних лет демонстрируют увеличение уровня заболеваемости подагрой по всему миру. Распространенность подагры среди взрослого населения Европы составляет 0,9–2,5%, в США — 1,4–2,8% [1], в Российской Федерации — 0,31% по данным 2006 г. [2, 3]. Аналогичные данные были получены по результатам оценки заболеваемости во взрослой популяции в России, проведенной в 2018 г., — распространенность подагры составила 300 и 100 больных на 100 тыс. взрослого населения для мужчин и женщин соответственно [4].
Риск возникновения подагры напрямую зависит от уровня содержания мочевой кислоты в плазме крови. Бóльшая часть исследователей связывают положительную корреляцию установки диагноза «подагра» с такими провоцирующими факторами, как мужской пол, ожирение, изменение условий питания и малая двигательная активность [5]. Кроме того, также следует отметить, что современные методы диагностики позволяют установить диагноз на максимально ранних стадиях заболевания [6].
Отрицательная динамика эпидемиологической ситуации диктует необходимость оценки эффективности назначаемых лекарственных препаратов, главным образом из группы нестероидных противовоспалительных средств (НПВС), для минимизации потенциальных экономических затрат. Экономические затраты, в свою очередь, могут носить сочетанный характер, а именно: прямые потери, связанные с первичным назначением лекарственных средств, и косвенные потери, связанные с покрытием расходов в связи с нежелательными лекарственными реакциями (в т. ч. межлекарственными взаимодействиями) [7].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Подагра — хроническое заболевание, развивающееся в связи с воспалением в местах отложения кристаллов моноурата натрия (МУН) у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [8].
Формирование кристаллов МУН в основном обусловлено генетическими факторами и характеризуется снижением экскреции мочевой кислоты с мочой либо ее гиперпродукцией [9]. Формирование и отложение кристаллов МУН происходит преимущественно в хрящевой ткани и окружающих сухожилиях и связках, что запускает классический и альтернативный пути активации системы комплемента, фактора Хагемана и каскада кининов. Процесс фагоцитоза МУН происходит преимущественно с участием полиморфноядерных лейкоцитов, что сопровождается выделением целого ряда провоспалительных медиаторов: интерлейкинов ИЛ-1, -6, -8, кахексина и др. Совокупность описанных этиопатогенетических механизмов манифестирует массивной воспалительной реакцией, клиническое проявление которой представляет собой острый приступ подагры [10].
КРИТЕРИИ ПОСТАНОВКИ ДИАГНОЗА
Патогенетические аспекты острого подагрического артрита обусловлены отложением и накоплением кристаллов уратов с образованием тофусов в мягких тканях, что в дальнейшем ведет к развитию таких состояний, как подагрическая нефропатия и нефролитиаз. Формирование тофусов является длительным рецидивирующим процессом и сопровождается выраженной клинической симптоматикой — повторяющимися атаками острого артрита [11].
При ведении пациентов с наличием ревматологических заболеваний со стороны медицинских служб различных стран мира была обозначена необходимость разработки единых подходов для диагностики и лечения данных состояний. В рамках этой задачи Американская коллегия ревматологов (American College of Rheumatology, ACR) и Европейская антиревматическая лига (European League Against Rheumatism, EULAR) приступили к разработке стандартизированных критериев диагностики (ACR-EULAR classification criteria for gout). Первая редакция классификационных критериев была одобрена ВОЗ в 2002 г. [12]. Документ проходит регулярный пересмотр ввиду появления новых данных об этиопатогенетических факторах, влияющих на течение ревматоидного артрита. Последняя редакция документа, одобренная в 2015 г. [13], сопоставима с федеральными клиническими рекомендациями, утвержденными на территории РФ в 2018 г. [14].
Классификационные критерии острого подагрического артрита, включенные в клинические рекомендации на территории Российской Федерации от 2018 г. [14], представлены ниже:
А. Наличие характерных кристаллов МУН в суставной жидкости.
Б. Наличие тофусов, содержание кристаллов мочевой кислоты в которых подтверждено химически или поляризационной микроскопией.
В. Наличие не менее чем 6 из 12 нижеперечисленных признаков:
- более одной атаки острого артрита в анамнезе;
- воспаление сустава достигает максимума в 1-й день
- болезни;
- моноартрит;
- гиперемия кожи над пораженным суставом;
- припухлость и боль в первом плюснефаланговом суставе;
- одностороннее поражение первого плюснефалангового сустава;
- одностороннее поражение суставов стопы;
- подозрение на тофусы;
- гиперурикемия;
- асимметричный отек суставов;
- субкортикальные кисты без эрозий (рентгенография);
- отрицательные результаты при посеве синовиальной жидкости.
Для определения диагноза подагры достаточно выявления кристаллов МУН в синовиальной жидкости или тофусах (пункты А и Б рекомендаций); при невозможности указанных исследований диагноз должен быть обоснован наличием совокупности клинических, лабораторных и инструментальных признаков (пункт В рекомендаций) [14].
ЛЕЧЕНИЕ ПОДАГРИЧЕСКОГО АРТРИТА
Для подбора оптимальной схемы терапии требуется комплексный подход, а именно данные анамнеза и физикального осмотра, оценка факторов риска (возраст, пол, наличие или отсутствие избыточной массы тела, сопутствующие заболевания) и данные лабораторно-инструментальных методов обследования (уровень мочевой кислоты, результаты рентгенографии) [15].
В соответствии с отечественными национальными клиническими рекомендациями по лечению подагры медицинские работники при лечении данного заболевания должны придерживаться алгоритма, представленного на рисунке 1.
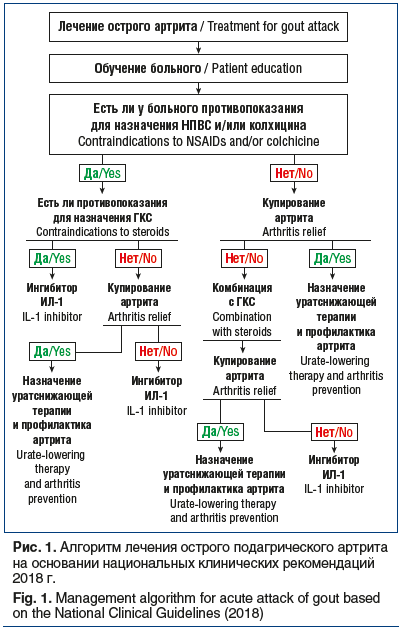
В качестве первой линии терапии принято рассматривать НПВС и/или колхицин [16].
Основной точкой приложения препаратов группы НВПС является ингибирование изофермента циклооксигеназы (ЦОГ). Существует два варианта данного изофермента — ЦОГ-1 и ЦОГ-2. Первый изофермент — ЦОГ-1 оказывает влияние на выработку простагландинов, медиаторов воспаления, образующихся при каскаде арахидоновой кислоты. Простагландины являются гормоноподобными веществами, влияющими на регуляцию кровяного давления, сокращение матки, целостность слизистых оболочек (в т. ч. ЖКТ), а также на систему гемостаза. Второй изофермент — ЦОГ-2 в нормальных условиях отсутствует, вырабатывается при наличии воспалительного процесса, образуется под действием тканевых факторов (цитокинов и др.) [17]. Классификация НПВС по селективности в отношении блокирования ЦОГ представлена в таблице 1 [18].
![Таблица 1. Классификация НПВС по селективности в отношении ингибирования ЦОГ [18] Table 1. Classification of NSAIDs based on the selectivity of COX inhibition [18] Таблица 1. Классификация НПВС по селективности в отношении ингибирования ЦОГ [18] Table 1. Classification of NSAIDs based on the selectivity of COX inhibition [18]](https://www.rmj.ru/upload/medialibrary/fd0/96-2.png)
Группа НПВС обладает широким фармакологическим профилем и включает в себя такие эффекты, как противовоспалительный, анальгезирующий, жаропонижающий, антиагрегантный и иммуносупрессивный.
Данные литературы демонстрируют, что наиболее эффективно оказывают противовоспалительный эффект следующие препараты группы НПВС: индометацин, диклофенак, фенилбутазон [19]. Указанные лекарственные препараты охватывают две фазы воспаления — экссудативную и пролиферативную. Таким образом, осуществляется склерозирующий и анальгезирующий эффекты соответственно. Степень анальгезии при этом достаточно высокая, в частности для диклофенака, кеторолака, кетопрофена, метамизола, фенилбутазона, что подтверждается данными обзоров литературы [20–22].
Вместе с тем применение НПВС ассоциировано с широким спектром нежелательных лекарственных реакций (НЛР). Согласно данным литературы наиболее частой НЛР является НПВС-гастропатия [23].
Авторами статьи была получена выгрузка НЛР из автоматизированной информационной системы Росздравнадзора (АИС РЗН) следующих препаратов: диклофенак, мелоксикам, фенилбутазон, ацетилсалициловая кислота, метамизол, целекоксиб, эторикоксиб — за период с 2010 по 2020 г. включительно. Количество зарегистрированных сообщений составило 8567. Полученные результаты обобщены в таблице 2.
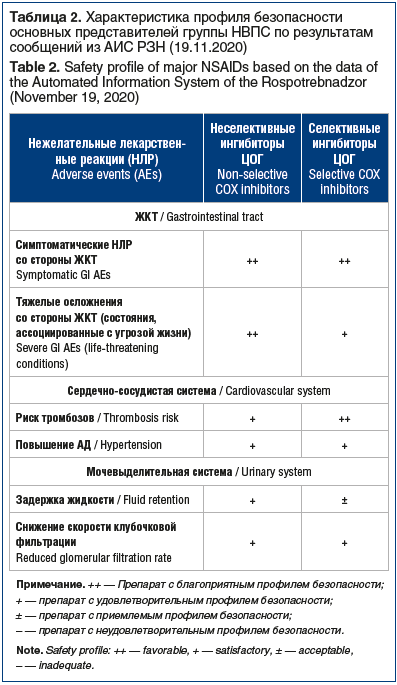
Полученные данные из АИС РЗН сопоставимы с результатами, представленными в других исследованиях. Так, в 2013 г. были опубликованы результаты ретроспективного когортного исследования по оценке рисков возникновения НЛР со стороны верхних отделов ЖКТ среди пациентов, принимающих НПВС (n=588 827), за период с 2001 по 2008 г. (Италия). У 3031 пациента были зарегистрированы случаи осложнений со стороны верхних отделов ЖКТ. Наиболее распространенным осложнением стало желудочно-кишечное кровотечение. Коэффициент частоты развития осложнений на 1000 пациенто-лет составил 3,8 (95% доверительный интервал 2,86, 3,76). При этом для лекарственных препаратов целекоксиб, нимесулид коэффициент частоты развития осложнений был <2, для напроксена, ибупрофена, диклофенака, эторикоксиба и мелоксикама данный показатель был в диапазоне от 2 до 5, а для кетопрофена, пироксикама и кеторолака — >5 [24].
В литературе имеются данные об использовании лекарственного препарата под торговым названием АМБЕНИУМ® (фенилбутазон + [лидокаин]) в качестве альтернативного НПВС. Препарат может применяться по следующим показаниям: острая боль, болевой синдром, обусловленный мышечно-скелетными расстройствами (в т. ч. при подагре, ревматоидном артрите и при анкилозирующем спондилите) [25].
Например, в исследовании, проведенном J. Boersma et al., была поставлена задача оценить ингибирующее влияние фенилбутазона на прогрессирование окостенения поясничного отдела позвоночника. Общая выборка пациентов составила 40 человек с анкилозирующим спондилитом, которые, в соответствии с дизайном исследования, были разделены на 3 группы: (А) непрерывное лечение фенилбутазоном; (B) лечение фенилбутазоном, но не в течение всего периода; (С) схема лечения без фенилбутазона. Наиболее быстрое прогрессирование окостенения произошло в группе С, в группе А формирование окостенения отсутствовало или было существенно замедленным. Таким образом, продемонстрировано, что на ранних (или относительно ранних) стадиях анкилозирующего спондилита терапия фенилбутазоном может полностью или в значительной степени контролировать оссификацию позвоночного столба [26]. Данные выводы также были подтверждены в ряде исследований [27].
Было проведено открытое сравнительное рандомизированное исследование в параллельных группах, в котором сравнивался анальгезирующий эффект препаратов АМБЕНИУМ® парентерал и диклофенак натрия у пациентов с острой болью в нижней части спины [28]. В исследовании приняли участие 164 пациента (возраст: от 18 до 72 лет), имеющих диагноз острой боли в нижней части спины, интенсивность которой составляла не менее 80 баллов по визуально-аналоговой шкале. Результаты проведенного исследования показали достаточную эффективность и безопасность препарата АМБЕНИУМ® парентерал в сравнении с диклофенаком натрия у этой категории пациентов. При этом анальгетический эффект после внутримышечного введения препарата АМБЕНИУМ® парентерал формировался через 1 ч и длился в течение 24 ч после введения.
Суммарно у пациентов, включенных в исследование, было зарегистрировано 14 НЛР, связанных с соматическим статусом: в 12 (86%) из 14 случаев зарегистрирована брадикардия неуточненная (код по МКБ — R00.1), в 1 (7%) случае — гиперемия (R23.2) и в 1 (7%) случае — головная боль (R51). При этом в группе применения препарата АМБЕНИУМ® парентерал было зарегистрировано 9 (64%) НЛР из 14 и в группе сравнения — 5 (36%) НЛР. Все НЛР были легкой степени, связь с препаратом была оценена как маловероятная, действия для купирования НЛР не предпринимались. В ходе вышеуказанного клинического исследования была показана хорошая общая и локальная переносимость препарата АМБЕНИУМ® парентерал.
Таким образом, резюмируя данные проведенных клинических исследований и литературных обзоров, профиль безопасности препарата АМБЕНИУМ® парентерал можно считать благоприятным. Кроме того, препарат АМБЕНИУМ® обладает относительно высокой биодоступностью, что во многом обусловлено его лекарственной формой.
ЗАКЛЮЧЕНИЕ
При назначении противоподагрической терапии со стороны лечащего врача требуется всесторонний анализ состояния пациента. НПВС при этом рассматриваются в качестве препаратов первой линии терапии острого подагрического артрита. Однако при назначении препаратов из группы НПВС следует принимать во внимание широкий спектр НЛР данного класса препаратов с оценкой риска их формирования и возможных межлекарственных взаимодействий, уделяя особое внимание подбору оптимальной дозировки и длительности терапии. Лекарственный препарат под торговым названием АМБЕНИУМ® (фенилбутазон + [лидокаин]), с учетом выраженного анальгетического эффекта и благоприятного профиля безопасности, может быть рекомендован в качестве альтернативного НПВС для купирования болевого синдрома при остром подагрическом артрите.

