Фенилбутазон: место неселективных НПВП в современной врачебной практике
Военно-медицинская академия имени С.М. Кирова, Санкт-Петербург
РЕЗЮМЕ
Несмотря на длинную историю применения нестероидных противовоспалительных препаратов (НПВП) в клинической практике, продолжаются исследования, посвященные сравнительной оценке эффективности и безопасности представителей различных классов НПВП, в том числе с учетом их селективности в отношении влияния на циклооксигеназу. Статья посвящена одному из наиболее известных и хорошо изученных препаратов — фенилбутазону. В обзоре отражены некоторые исторические аспекты применения фенилбутазона, особенности его фармакокинетики и фармакодинамики, обусловливающие пролонгированный эффект, указаны основные побочные реакции и способы их контроля. Обоснована целесообразность использования парентеральных форм НПВП, в частности фенилбутазона, у пациентов с острой болью, обеспечивающих, прежде всего, быстрое наступление анальгезирующего эффекта. Отмечено, что взвешенный подход к применению фенилбутазона может свести к минимуму риск развития серьезных токсических реакций, прежде всего со стороны костного мозга, существенно ограничивающих использование
препарата специалистами, в том числе в амбулаторной практике. Представлены результаты исследований, подтверждающих эффективность и безопасность применения инъекционной формы фенилбутазона для купирования острого болевого синдрома, связанного с дегенеративно-дистрофическими и ревматическими заболеваниями опорно-двигательного аппарата.
Ключевые слова: фенилбутазон, нестероидные противовоспалительные препараты, эффективность, безопасность, острая боль.
Для цитирования: Свинцицкая И.С., Волков К.Ю., Бологов С.Г. Фенилбутазон: место неселективных НПВП в современной врачебной практике. РМЖ. 2021;7:62–65.
Введение
Благодаря своему обезболивающему, жаропонижающему и противовоспалительному действию нестероидные противовоспалительные препараты (НПВП) используются во всем мире у пациентов с различными заболеваниями травматологического, ревматологического, терапевтического, неврологического и хирургического профилей. НПВП, как правило, не влияют на течение основного заболевания и используются в основном для облегчения симптомов [1]. Существует более 20 различных НПВП шести основных классов, определяемых их химической структурой. Эти препараты различаются по дозе, лекарственному взаимодействию и некоторым побочным эффектам, однако имеют основные черты, характерные для большинства препаратов этого класса.
Все НПВП полностью абсорбируются из желудочно-кишечного тракта, незначительно метаболизируются в печени при первом прохождении, имеют небольшие объемы распределения и хорошо связываются с белками
плазмы, преимущественно альбумином, поэтому пациенты с гипоальбуминемией (например, из-за цирроза печени или активного ревматоидного артрита) могут иметь более высокую концентрацию препарата в сыворотке [1].
Период полувыведения НПВП варьирует, но в целом их можно разделить на препараты короткого действия (менее 6 ч) и длительного действия (более 6 ч) [1].
Первичный эффект НПВП заключается в ингибировании циклооксигеназы (ЦОГ), представленной двумя изо-
формами, ЦОГ-1 и ЦОГ-2, что препятствует превращению арахидоновой кислоты в простагландины, простациклин и тромбоксаны. ЦОГ-1 экспрессируется в большинстве тканей и является ферментом, регулирующим нормальные клеточные процессы (такие как цитопротекция желудка, сосудистый гомеостаз, агрегация тромбоцитов и функция почек), экспрессия ЦОГ-1 регулируется гормонами или факторами роста. ЦОГ-2 обычно не обнаруживается, ее продукция увеличивается при воспалении или экспериментально в ответ на митогенные стимулы [1].
Нестероидные противовоспалительные препараты, способные за короткий промежуток времени снизить интенсивность боли и повысить качество жизни пациента, часто назначаются в амбулаторной практике. Однако для достижения максимального анальгетического эффекта, как правило, требуется применение НПВП в максимальных терапевтических дозировках. При этом сохраняет свою актуальность вопрос о безопасности применения НПВП в разных лекарственных формах [2]. В связи с этим в настоящее время наблюдается тенденция к более частому использованию парентеральных форм НПВП из-за их более высокой биодоступности, обеспечивающей ускоренное наступление анальгетического эффекта в сравнении с пер-
оральными формами [3].
В многочисленных сравнительных исследованиях использования селективных и неселективных НПВП пациентами с заболеваниями опорно-двигательного аппарата установлено, что при назначении в средних и высоких дозах по анальгетическому и противовоспалительному эффекту препараты не отличаются [4].
В данном аспекте представляется уместным поговорить о давно известном и хорошо изученном препарате — фенилбутазоне.
Фенилбутазон: безопасность и эффективность
Фенилбутазон — НПВП, относящийся к группе пиразолонов, был широко введен в медицинскую практику в 1949 г. как новое средство класса НПВП для использования при лечении острой и хронической воспалительной боли. Он оказался хорошим анальгетиком и в течение 30 лет широко использовался в хирургии и травматологии (для купирования болевого синдрома, в том числе послеоперационного), спортивной медицине, неврологии (в комплексном лечении дегенеративно-дистрофических заболеваний позвоночника), ревматологии (для лечения различных форм артритов) [5–10]. Однако в 1980-х годах в ряде европейских стран и в США были наложены ограничения на использование фенилбутазона у людей по причине того, что он в редких случаях вызывал гематотоксические реакции, включая апластическую анемию, лейкопению, агранулоцитоз и тромбоцитопению [11].
Фенилбутазон является одним из наиболее изученных НПВП. Он имеет обширную доказательную базу эффективности, включающую около 200 рандомизированных исследований [5–8, 12, 13] и ряд метаанализов [14, 15]. Фенилбутазон обладает всеми тремя классическими эффектами, присущими НПВП: анальгетическим, противовоспалительным и жаропонижающим [12, 16–18]. В ряде исследований было показано, что по выраженности противовоспалительного эффекта фенилбутазон превосходит аспирин. Так, например, R.G. Godfrey et al. [19] в двойном слепом перекрестном исследовании показали более высокую эффективность фенилбутазона в лечении анкилозирующего спондилита по сравнению с аспирином. P.M. Brooks et al. [20] сравнили эффективность парацетамола 3 г и аспирина 3,6 г в день с 50 мг или 300 мг фенилбутазона при лечении полиартрита. Установлено, что высокие дозы фенилбутазона превосходили комбинированную терапию, которая, в свою очередь, превосходила низкие дозы фенилбутазона (оценка боли в течение 2 нед. (скорректированная для исходной оценки боли): 2,8 (стандартное отклонение 0,2) для фенилбутазона 300 мг по сравнению с 3,1 (стандартное отклонение 0,2) для парацетамола 3 г и аспирина 3,6 г и 3,3 (стандартное отклонение 0,2) для фенилбутазона 50 мг (p<0,05)).
Фармакокинетический профиль фенилбутазона у людей характеризуется очень медленным клиренсом, обширным метаболизмом, длительным конечным периодом полувыведения и очень высокой степенью связывания (98–99%) с белками плазмы, главным образом с альбумином [11]. Максимальная концентрация в крови достигается через 2 ч после приема внутрь и только через 6–8 ч после введения внутримышечно (так как фенилбутазон связывается тканями в месте инъекции). Период полувыведения составляет около 70 ч, но может различаться у разных пациентов, варьируя от 54 ч до 99 ч, что, скорее всего, обусловлено генетическими особенностями [21, 22].
Широкое применение фенилбутазона в настоящее время ограничивают его частые и серьезные нежелательные явления (НЯ), которые, по данным литературы, регистрировали у 45% больных [23]. Наиболее известными побочными реакциями являются диффузный гастрит, язва желудка, венозный тромбоз, нефрит и хроническое повреждение почек [24].
Отдельного внимания заслуживает депрессивное действие препарата на костный мозг, следствием которого являются гематотоксические реакции, такие как апластическая анемия и агранулоцитоз, часто приводящие к летальному исходу. Риск апластической анемии более высок у женщин, у людей старше 40 лет и при длительном применении. Также отмечено развитие лейкопении, тромбоцитопении, панцитопении и гемолитической анемии [25, 26].
Однако следует отметить, что большинство гематотоксических эффектов были обусловлены высокой применяемой дозой (до 1600 мг/сут) [27] и длительным временем приема препарата [28]. При этом E. Bruck et al. [29], предположив увеличение частоты токсических эффектов при более высоких уровнях препарата в плазме, наблюдая 52 пациента, зарегистрировали только 1 случай угнетения костного мозга, указав на отсутствие четкой связи между уровнем препарата в плазме и токсическим действием на костный мозг.
В дальнейшем, при применении дозировки порядка 300–600 мг/сут, неблагоприятные гематологические эффекты стали регистрировать гораздо реже. В 2018 г. M. Worboys et al. [30] указали на избыточные опасения в отношении НЯ при применении фенилбутазона. Высокая частота НЯ, включая тяжелые, больше зависела не от самого препарата, а от дозы и длительности его использования. В случае адекватного подбора дозировки и кратности введения фенилбутазон в качестве анальгетика, обеспечивающего кратковременный эффект, представляется вполне безопасным лекарственным средством, в том числе при наличии коморбидной патологии. Его применение не несет в себе чрезмерных рисков и может дать хорошие результаты. Так, метаанализ краткосрочных исследований использования НПВП при анкилозирующем спондилите не выявил дополнительных рисков НЯ со стороны желудочно-кишечного тракта при применении фенилбутазона по сравнению с другими НПВП [15]. 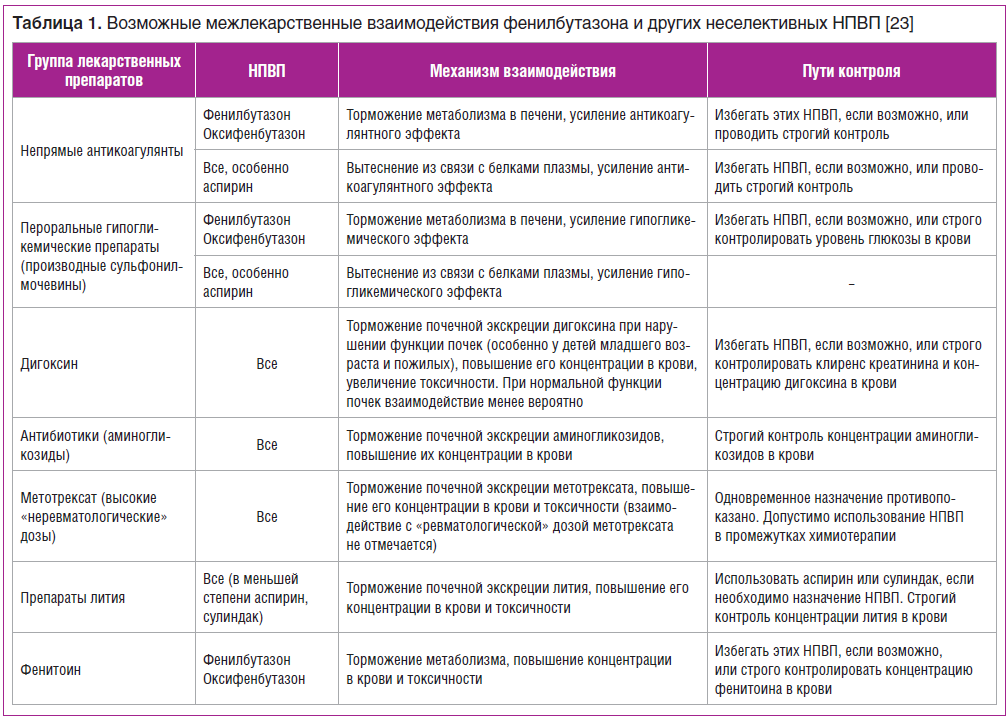 Назначая фенилбутазон, также следует учитывать его взаимодействие с другими препаратами (табл. 1).
Назначая фенилбутазон, также следует учитывать его взаимодействие с другими препаратами (табл. 1).
Однако вопросы купирования острого болевого синдрома остаются достаточно сложными, что стало особенно очевидно в условиях пандемии COVID-19. Ограничение возможности стационарного лечения с применением сильнодействующих анальгетиков и/или глюкокортикостероидов (ГКС) из-за перепрофилирования стационаров под лечение новой коронавирусной инфекции, дефицита ГКС или наличия у пациента противопоказаний к их назначению требует от врачей амбулаторного звена принятия верного решения для назначения адекватной эффективной и безопасной терапии.
Одним из возможных вариантов решения этого вопроса может быть применение инъекционных форм НПВП, что позволяет достичь обезболивающего эффекта в максимально короткие сроки и тем самым избежать развития потенциальных НЯ. Несмотря на то, что эффективность анальгезии для пероральной и парентеральной форм препаратов, как правило, сопоставима, именно скорость наступления анальгезии определяется как преимущество парентеральной формы НПВП [31, 32], что особенно актуально при интенсивной острой боли [33, 34]. Что касается возможности замены опиоидных анальгетиков на НПВП, то было показано, например, что у пациентов с остеоартритом коленного сустава НПВП, как селективные, так и неселективные, демонстрируют сопоставимую эффективность [35].
В нашей стране инъекционная форма фенилбутазона известна под торговым наименованием АМБЕНИУМ® парентерал. В последнее время проведен ряд исследований, показавших достаточную эффективность и безопасность препарата у пациентов с остеоартритом, болью в нижней части спины, ревматоидным артритом, подагрой [3, 36, 37]. Так, В.А. Нестеренко и соавт. [37] показали, что трехкратное внутримышечное введение препарата АМБЕНИУМ® парентерал в дозе 2 мл с интервалом 7 дней обеспечило достоверное снижение интенсивности боли в коленном суставе с 40 до 20 баллов по ВАШ. Причем полное купирование боли констатировали у 33,3% пациентов моложе 45 лет с посттравматическим остеоартритом. На фоне снижения интенсивности болевого синдрома пациенты не нуждались в дополнительном приеме другого НПВП, отмечалось восстановление основных функций жизнедеятельности у 43,33% пациентов. Положительный клинический эффект был подтвержден результатами УЗИ: уменьшением толщины синовиальной оболочки и количества жидкости в сумке. Отсутствие серьезных НЯ, потребовавших отмены дальнейших введений препарата, подтвердило хорошую переносимость препарата в использованном режиме дозирования.
Открытое сравнительное рандомизированное исследование в параллельных группах было посвящено сравнению анальгезирующего эффекта препаратов АМБЕНИУМ® парентерал и диклофенак натрия у пациентов с острой болью в нижней части спины интенсивностью не менее 80 баллов по ВАШ [3]. Однократные инъекции препаратов продемонстрировали их сопоставимые эффективность и безопасность. При этом анальгетический эффект после внутримышечного введения препарата фенилбутазона формировался через 1 ч и сохранялся в течение 24 ч после введения [3]. Все зарегистрированные НЯ были легкой степени, не требовали дополнительных мер для их купирования, связь их развития с приемом препарата была оценена как маловероятная.
Заключение
При назначении препаратов из группы НПВП следует принимать во внимание широкий спектр НЯ данного класса препаратов с оценкой риска их формирования и возможных межлекарственных взаимодействий, уделяя особое внимание подбору оптимальной дозировки и длительности терапии.
Одним из возможных путей сведения к минимуму риска НЯ является изменение способов введения и режимов дозирования. Так, например, назначение фенилбутазона коротким курсом может быть уместно при высокоинтенсивной боли. Длительный период полувыведения препарата позволяет сохранить достаточный анальгетический эффект в течение 24 ч. Предварительные данные позволяют говорить о том, что короткий курс (1–3 инъекции) парентеральной формы фенилбутазона обеспечивает эффективное купирование боли, улучшение качества жизни пациента, не вызывая при этом выраженных побочных эффектов. Это особенно актуально на амбулаторном этапе, когда нет возможности применения сильнодействующих веществ и ГКС.
Благодарность
Авторы и редакция благодарят ООО «ТРИВИУМ-ХХI» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Литература
1. Solomon D.H. NSAIDs: Pharmacology and mechanism of action. UpToDate. Waltham, MA: UpToDate Inc. (Electronic resource.) URL: https://www. uptodate. com/ contents/nsaids-pharmacology-and-mechanism-of-action (access date: 08.15.2021).
2. Zhang S., Zhang Y., Liu P. et al. Efficacy and safety of etoricoxib compared with NSAIDs in acute gout: a systematic review and a meta-analysis. Clin Rheumatol. 2016;35(1):151–158.
3. Василюк В.Б., Фарапонова М.В., Сыраева Г.И. Выбор НПВП для лечения острой и хронической боли у пациентов с ревматоидным артритом на амбулаторно-поликлиническом этапе. РМЖ. 2020;12:30–34. [Vasilyuk V.B., Faraponova M.V., Syraeva G.I. Selection of NSAIDs for the treatment of acute and chronic pain in patients with rheumatoid arthritis at the outpatient stage. RMJ. 2020;12:30–34 (in Russ.)].
4. Stam W., Jansen J., Taylor S. Efficacy of etoricoxib, celecoxib, lumiracoxib, nonselective NSAIDs, and acetaminophen in osteoarthritis: a mixed treatment comparison. Open Rheumatol J. 2012;6:6–20. DOI: 10.2174/1874312901206010006.
5. Bird H.A., Leatham P.A., Lowe J.R. et al. A phenylbutazone dose-finding study in rheumatoid arthritis. Eur J Clin Pharmacol. 1983;24(6):773–776. DOI: 10.1007/ BF00607086.
6. Mena H.R., Willkens R.F. Treatment of ankylosing spondylitis with flurbiprofen or phenylbutazone. Eur J Clin Pharmacol. 1977;11(4):263–266. DOI: 10.1007/BF00607674.
7. Brooks P.M., Walker J.J., Dick W.C. Phenylbutazone: a clinico‐pharmacological study in rheumatoid arthritis. Br J Clin Pharmacol. 1975;2(5):437–442. DOI: 10.1111/j.1365-2125.1975.tb00553.x.
8. Jesting E., Bastruf‐Madsen P., Bechgaard P. Phenylbutazone in small doses in the treatment of joint diseases. Acta Med Scand. 1958;160(4):304–314.
9. Hughes W. Phenylbutazone. The Lancet. 1953;262(6775):39–40.
10. Crowe H.W. Phenylbutazone as analgesic. The Lancet. 1955;265(6873):1076–1077. DOI: 10.1016/S0140-6736(55)91152-1.
11. Lees P., Toutain P. Pharmacokinetics, pharmacodynamics, metabolism, toxicology and residues of phenylbutazone in humans and horses. Vet J. 2013;196:294–303. DOI: 10.1016/j.tvjl.2013.04.019.
12. Lees P., Higgins A.J. Clinical pharmacology and therapeutic uses of non-steroidal anti-inflammatory drugs in the horse. Equine Vet J. 1985;17:83–96. DOI: 10.1111/j.2042-3306.1985.tb02056.x.
13. Grahame R., Calin A. A controlled trial of ‘Froben’(flurbiprofen) in ankylosing spondylitis — comparison with phenylbutazone. Curr Med Res Opin. 1975;3(4):42–44.
14. Ramiro S., Radner H., van der Heijde D.M. et al. Combination therapy for pain management in inflammatory arthritis: a Cochrane systematic review. J Rheumatol Suppl. 2012;90:47–55. DOI: 10.3899/jrheum.120342.
15. Runsheng Wang R., Dasgupta A., Ward M.M. Comparative efficacy of nonsteroidal anti-inflammatory drugs in ankylosing spondylitis: a Bayesian network meta-analysis of clinical trials. Ann Rheum Dis. 2016;75(6):1152–1160. DOI: 10.1136/ annrheumdis-2015-207677.
16. Toutain P.L. Autefage A., Legrand C. et al. Plasma concentrations and therapeutic efficacy of phenylbutazone and flunixin meglumine in the horse: pharmacokinetic/pharmacodynamic modelling. J Vet Pharmacol Ther. 1994;17(6):459–469. DOI: 10.1111/j.1365-2885.1994.tb00278.x.
17. Vane J.R. Inhibition of prostaglandin synthesis as a mechanism of action for aspirinlike drugs. Nat New Biol. 1971;231(25):232–235. DOI: 10.1038/newbio231232a0.
18. Lees P., Landoni M.F., Giraudel J., Toutain P.L. Pharmacodynamics and pharmacokinetics of nonsteroidal anti‐inflammatory drugs in species of veterinary interests. J Vet Pharmacol Ther. 2004;27(6):479–490. DOI: 10.1111/j.1365-2885.2004.00617.x.
19. Godfrey R.G., Calabro J.J., Mills D., Maltz B.A. A double blind cross over trial of aspirin, indomethacin and phenylbutazone in ankylosing spondylitis. Arthritis and Rheumatism. 1972;15:110.
20. Brooks P.M., Walker J.J., Lee P. et al. [Clinical study on a new acetylsalicylic acid/paracetamol preparation with gastric acid resistant coating (Safapryn), and on two various phenylbutazone dosages in patients with primary chronic polyarthritis as based on a new evaluation method] Z Rheumatol. 1975;34(9–10):350–365.
21. Aarbakke J. Clinical pharmacokinetics of phenylbutazone. Clin Pharmacokinet. 1978:3(5):369–380. DOI: 10.2165/00003088-197803050-00003.
22. Sioufi A., Colussi D., Caudal F. et al. Pharmacokinetics of phenylbutazone in healthy subjects after oral administration of single and multiple doses. J Pharm Sci. 1980;69(12):1413–1416. DOI: 10.1002/jps.2600691216.
23. Страчунский Л.С., Козлов С.Н. Нестероидные противовоспалительные средства (Электронной ресурс.) URL: http://www. antibiotic. ru/rus/all/metod/npvs/npvs.shtml. (дата обращения: 15.08.2021). [Strachunsky L.S., Kozlov S.N. Non-steroidal anti-inflammatory drugs (Electronic resource.) URL: http://www. antibiotic. ru/rus/all/metod/npvs/npvs.shtml (access date: 08.15.2021) (in Russ.)
24. Bindu S., Mazumder S., Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem Pharmacol. 2020;180:114147. DOI: 10.1016/j.bcp.2020.114147.
25. Stephens C.A.L., Yeoman E.E., Holbrook W.P. et al. Benefits and toxicity of phenylbutazone (butazolidin) in rheumatoid arthritis. J Am Med. Assoc. 1952;150(11):1084–1086. DOI: 10.1001/jama.1952.03680110024007.
26. Fowler P.D. Marrow toxicity of pyrazoles Ann Rheum Dis 1967;26:3445.
27. Sperling I.L. Adverse reactions with long-term use of phenylbutazone and oxyphenbutazone. The Lancet. 1969;294(7619):535–537.
28. Ramsey R., Golde D.W. Aplastic anemia from veterinary phenylbutazone. JAMA. 1976;236(9):1049.
29. Bruck E., Fearnley M.E., Meanock I., Patley H. Phenylbutazone therapy, relation between the toxic and therapeutic effects and the blood level. Lancet. 1954;1:225–228.
30. Worboys M., Toon E. Phenylbutazone (Bute, PBZ, EPZ): One drug across two species. Hist Philos Life Sci. 2018;40(2):27. DOI: 10.1007/s40656-018-0191-4.
31. Combe B., Vélicitat P., Garzón N., Bluhmki E. Comparison of intramuscular and oral meloxicam in rheumatoid arthritis patients. Inflamm Res. 2001;50 Suppl 1:S10–S6. DOI: 10.1007/PL00022374.
32. Dougados M., Listrat V., Duchesne L., Amor B. [Comparative efficacy of ketoprofen related to the route of administration (intramuscular or per os). A double-blind study versus placebo in rheumatoid arthritis]. Rev Rhum Mal Osteoartic. 1992;59(11):769–773.
33. Pathan S.A., Mitra B., Cameron P.A. A Systematic Review and Meta-analysis Comparing the Efficacy of Nonsteroidal Antiinflammatory Drugs, Opioids, and Paracetamol in the Treatment of Acute Renal Colic. Eur Urol. 2018;73(4):583–595. DOI: 10.1016/j.eururo.2017.11.001.
34. Machado G.C., Maher C.G., Ferreira P.H. et al. Non-steroidal antiinflammatory drugs for spinal pain: a systematic review and metaanalysis. Ann Rheum Dis. 2017;76(7):1269–1278. DOI: 10.1136/annrheumdis-2016-210597.
35. Smith S.R., Deshpande B.R., Collins J.E. et al. Osteoarthritis Cartilage. Comparative pain reduction of oral non-steroidal anti-inflammatory drugs and opioids for knee osteoarthritis: systematic analytic review. 2016;24(6):962–972. DOI: 10.1016/j.joca.2016.01.135.
36. Василюк В.Б., Сыраева Г.И., Фарапонова М.В. Обзор эффективности и безопасности нестероидных противовоспалительных препаратов для лечения острого приступа подагрического артрита. Русский медицинский журнал. Медицинское обозрение. 2021;5(2):96–101. [Vasilyuk V.B., Syraeva G.I., Faraponova M.V. Efficacy and safety of non-steroidal anti-inflammatory drugs for acute attack of gout. Russian Medical Inquiry. 2021;5(2):96–101 (in Russ.)]. DOI: 10.32364/2587-6821-2021-5-2-96-101.
37. Нестеренко В.А., Каратеев А.Е., Зеленов В.А., Зотов Е.Г. Эффективность и безопасность использования фенилбутазона для внутримышечного введения при остеоартрите коленного сустава. РМЖ. 2021;29(6):63–66. [Nesterenko V.A., Karateev A.E., Zelenov V.A., Zotkin E.G. Efficacy and safety of phenylbutazone use intramuscularly in knee osteoarthritis. RMJ. 2021;6:63–66 (in Russ.)].

